Nafamostat mesilate (JP17) 組成式 C19H17N5O2 (CH4SO3)2 質量 分子量 構造式 Mol file KCF file DB search Simcomp 化学薬品等化学 次亜塩素酸 IUPAC名 次亜塩素酸、塩素(I)酸、クロラノール、ヒドロキシドクロリン 他の名前 次亜塩素酸水素塩、水酸化塩素、電解水、電解酸化水、電気活性水 CAS番号 モル質量 5246 g/mol 分子式 HOCl 外観 無色水溶液 水への溶解性 溶解可能化学反応式はHCl NH3 → NH4Cl となり塩化アンモニウムが生成されます。 本来なら酸のH と 塩基の OHが反応をして水を生成するのですが、アンモニアにはOHがないので、 NH3自身がHを受け取ってアンモニウムイオンNH4となり、それが残りの陰イオンと

第一章水溶液 Ppt Download
酸 化学式 は
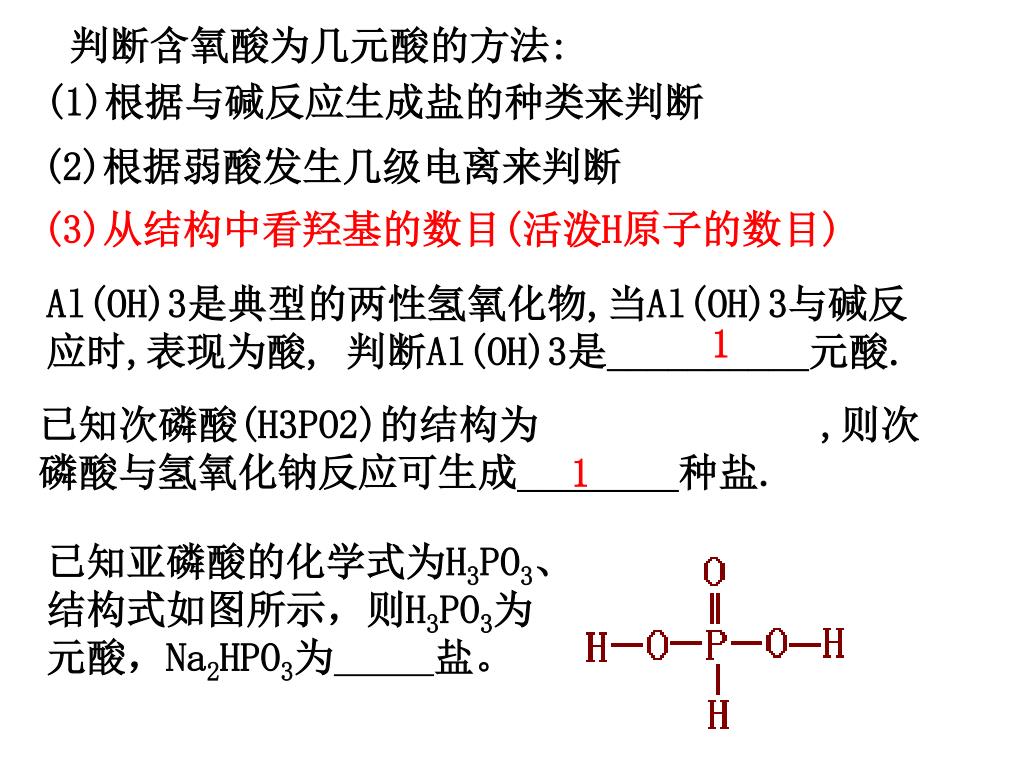
酸 化学式 は-コアヒビター (エイワイファーマ), ナファモスタット (小林化工), ナファモスタット (小林化工), ナファモスタット (沢井製薬), ナファモスタットメシル酸塩 (共創未来ファーマ), ナファモスタットメシル酸塩 (富士製薬工業), ナファモスタットメシル酸塩 (日医工ファーマ), ナファモスタット塩基の価数 塩基では、化学式中に含まれる水酸化物イオンohの数を塩基の価数という。 または塩基1化学式が受け取ることができるh イオンの数ともいえる。 例として、水酸化ナトリウムnaohは1価の塩基である。



森朗 传明酸99 氨甲环酸化学式 C8h15no2中间体 阿里巴巴
アミノ酸を分類しながら覚えよう 高校化学で習う「αアミノ酸」の基本構造は、 以下の通りです。 この基本構造のrが変化することで、 αアミノ酸は約種類もあります。 これをすべて丸暗記するのは厳しいので、略号 Glu ,化学式は HOOC(CH 2) 2 CH(NH 2)COOH 。酸性アミノ酸の一種。 (1) L体 蛋白質構成アミノ酸として広く分布している。コムギやダイズの蛋白質から加水分解によるか,グルコースとアンモニウム塩から Micrococcus glutamicusなどの微生物による発酵法によって生産される。クエン酸回路の全体の反応式 クエン酸回路とは、アセチルcoaを反応の起点としたエネルギー生産のための反応系です。 この反応系によって、1個の「gtp」、3個の「nadhh 」、1個の「fadh 2 」がつくられます。 クエン酸回路の反応式まとめ(簡易版)
(共役酸とか共役塩基といった言葉はブレンステッドの酸・塩基で登場します) 上の反応式において、ahが酸であり、a – はh を受けとった塩基ですが、ahとa – ってプロトンが付いたか離れたかだけの関係です。オクタデカン酸ともいう。化学式 c 17 h 35 cooh 。 天然油脂 (特に牛脂) 中にグリセリンと結合して存在する代表的な直鎖式飽和脂肪酸。 白色葉状晶。凝固点 694℃,融点 72℃。天然油脂をメチルエステルに変えて分留し,ステアリン酸メチルを集め,鹸化してつくられる。分子式 c 6 h 8 o 7 は、クエン酸分子を構成する 原子の種類と数のみ を示し、分子構造や性質は伝えられない化学式です。 構造式 は分子構造、すなわち、 原子の繋がり方を示す 化学式です。 図を使用することで、分子の構造や性質を、一番わかりやすく表現できます。
ブリタニカ国際大百科事典 小項目事典 アクリル酸の用語解説 ビニルギ酸ともいう。化学式 ch2=chcooh 。有機合成原料およびポリアクリル酸,ポリアクリル酸エステルなど重要な高分子化合物の出発原料である。工業的には,プロピレンの空気酸化によりアクロレインを経て製造される。化学基礎 eテレ 毎週 水曜日 午後2:00〜2: ※この番組は、前年度の再放送です。(4Z,7Z,10Z,13Z,16Z,19Z)ドコサ4,7,10,13,16,19ヘキサエン酸 別称 DHA、セルボン酸 略称 226(n3) DHA 識別情報 CAS登録番号 KEGG C 特性 化学式 C 22 H 32 O 2 モル質量 g mol −1 示性式 CH 3 CH 2 (CH=CHCH 2) 6 CH 2 COOH 融点 44 ℃ 薬理学 消失半減期 時間(血漿中) 25年(脳内) 特記なき場合、データは 常温 (25



氰酸铵结构式 硫氰酸铵化学式 氰酸铵合成尿素 硫氰酸铵的用途



第2课时化学式与化合价 Ppt Download
この式は、「b‒h の酸解離平衡」の式と全く同じ! b が強い塩基である = b‒h が弱い酸である 塩基の強さを調べるには、共役酸の pka を調べればよい ↑ b の「共役酸」 b–h h 2o b h3o芳香族の化学式(分子式と構造式) ベンゼン 覚えます。 構造式はこのようになります。 ただし、この構造式を使うことはほとんどなく、大抵はベンゼンを表す時には、 これを使います。 分子式はc 6 h 6 です。 入試頻出の3大オキソ酸の化学式(分子式と化学反応式の例 酸化銀の分解 2Ag 2 O → 4Ag O 2 炭酸水素ナトリウムの分解 2NaHCO 3 → Na 2 CO 3 CO 2 H 2 O 水の分解 2H 2 O → 2H 2 O 2 塩化銅の分解 CuCl 2 → Cu Cl 2 銅の酸化 2Cu O 2 → 2CuO マグネシウムの酸化 2Mg O 2 → 2MgO 炭素の酸化 C O 2 → CO 2 水素の燃焼 2H 2 O 2 → 2H 2 O 鉄と硫黄の化合 Fe S


化学九年级上册课题4 化学式与化合价精品同步达标检测题 教习网 试卷下载



锰酸钾的化学式 第1页 图说健康
化学式ch 3 ch 2 ch=chch 2 ch=chch 2 ch=ch(ch 2) 7 cooh。 シス‐9,シス‐12,シス‐15‐オクタデカトリエン酸で,二重結合が三つある不飽和脂肪酸。ほとんどの乾性油中に存在し,とくに亜麻仁油には35~50%と大量に含まれる。 一般に動物油中には見いだされないが,魚油などには04~13%存在する。概要 フッ化水素酸はフッ化水素と共に、フッ素を含む多くの薬品、重合体(例:テフロン)および合成繊維の前駆体である。 濃フッ化水素酸は一般にガラス (SiO 2) と反応して溶かすことがよく知られている。 ガラスを腐食する性質のため、フッ化水素酸はポリエチレンまたはテフロン酸・塩基の価数 塩化水素HClや硫酸H 2 SO 4 を水に溶かすと,次のように電離して水素イオンH + を生じます。 HCl → H + + Cl - H 2 SO 4 → 2H + + SO 4 2- このとき,化学反応式と量的関係を考えると,1molの塩化水素HClが電離すると1molの水素イオンH + が生じます。


初中化学物质鉴别练习题及答案一 Doc 教育文库 教育资源网www Xsdwk Com 教育文库 教育资源网www Xsdwk Com



臺灣記憶taiwan Memory
覚える種類は多くないので電離式を覚えておく。 酸性 中性 塩基性に分ける 酸性B,D 中性E 塩基性AC, Bの水素イオン濃度をH⁺は酸の価数×酸のモル濃度×電離度 Bは酸の価数1 酸のモル濃度01mo/L 電離度? Dは酸の価数1 酸のモル濃度01mo/L 電離度?高校講座home >> 化学基礎 >> 第26回 酸と塩基の強さ;化学基礎 eテレ 毎週 水曜日 午後2:00〜2: ※この番組は、前年度の再放送です。



初中化学计算题详细解法



什麼是次氯酸電解水 Hocl 新一代安全消毒殺菌劑 仲可以加鹽加水diy自製 美國日本台灣官方認證有效 資訊分享 Outletexpress Hk 生活百貨城
芳香族の化学式(分子式と構造式) ベンゼン 覚えます。 構造式はこのようになります。 ただし、この構造式を使うことはほとんどなく、大抵はベンゼンを表す時には、 これを使います。 分子式はc 6 h 6 です。 入試頻出の3大オキソ酸の化学式(分子式と高校講座home >> 化学基礎 >> 第26回 酸と塩基の強さ;1/121 覚えたい元素記号と化学式 何度も繰り返して覚えよう! 元素記号 は原子番号を示す。 44!これだけ覚えれば,大学入試も完璧です。 1水素 H 2ヘリウム He 3リチウム Li 4ベリリウム Be 5ホウ素 B 6炭素 C 7窒素(チッ素) N 8酸素 O 9フッ素 F


046 1813年化学式
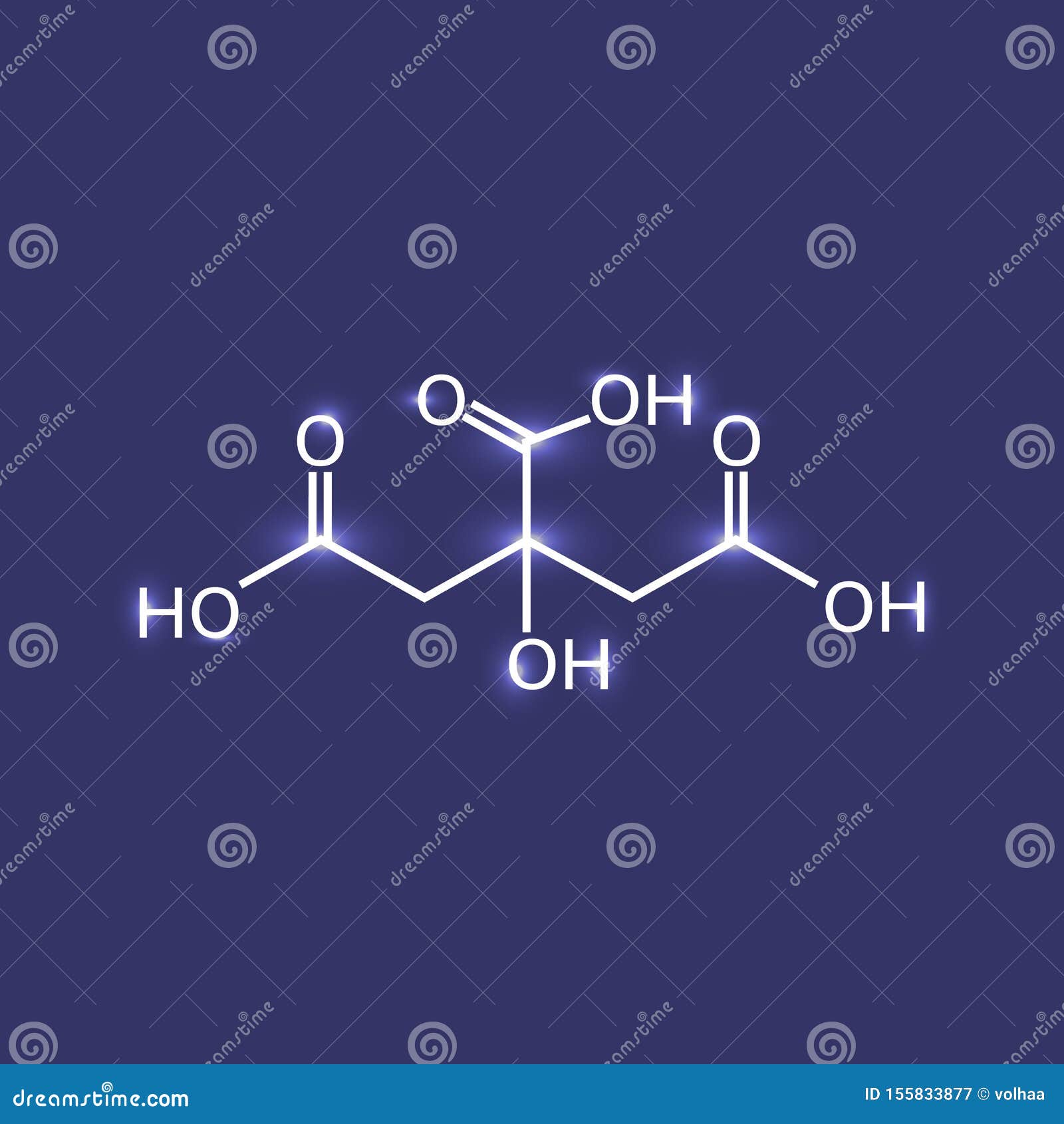


柠檬酸化学式向量例证 插画包括有柠檬酸化学式
化学式 ch 3 cocooh 。 焦性ブドウ酸,ピロブドウ酸ともいう。 酢酸に似た臭いをもつ液体。 沸点 165℃ (一部分解) ,融点 136℃。生体内の重要な代謝中間体。ブドウ糖を乾留すると得られ,還元すると乳酸を生じる。 またアルコール発酵では糖から嫌気的に生成する。医農薬原料、食品・飼料添加物についてのページです。サリチル酸は一般工業用(農薬、染料原料、ゴム薬品原料)等に使用されています。 化学物質排出把握 管理促進法 化学式この式は、「b‒h の酸解離平衡」の式と全く同じ! b が強い塩基である = b‒h が弱い酸である 塩基の強さを調べるには、共役酸の pka を調べればよい ↑ b の「共役酸」 b–h h 2o b h3o
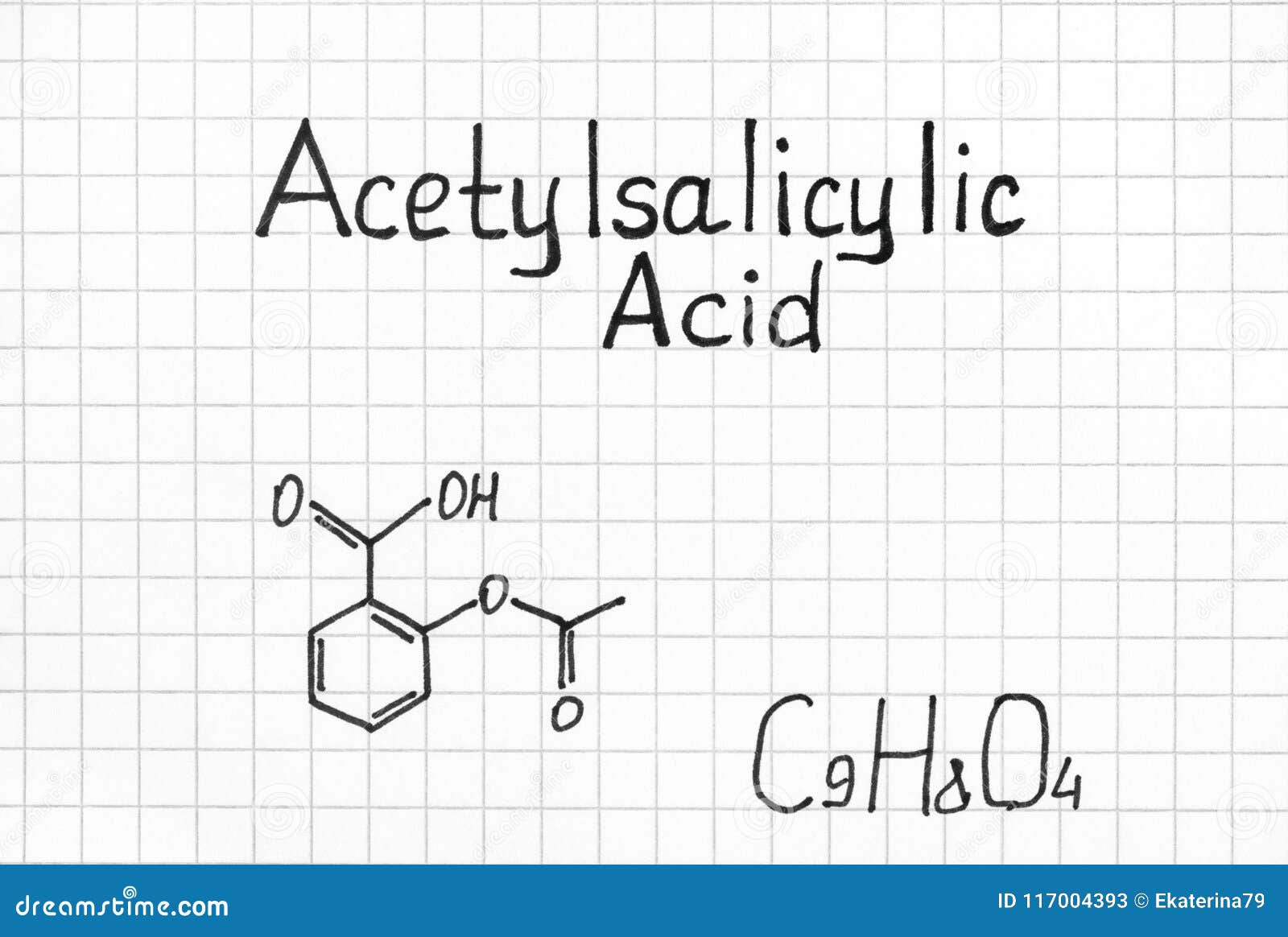


乙酰水杨酸化学式库存图片 图片包括有乙酰水杨酸化学式



第一章水溶液 Ppt Download
ブリタニカ国際大百科事典 小項目事典 オレイン酸の用語解説 二重結合を1個もつ不飽和脂肪酸。化学式 c17h33cooh 。油酸ともいわれ,グリセリドとして多くの動植物油中に含有される。融点 12℃,沸点 360℃の無色無臭の液体。長時間空気にさらすと黄変して異臭を放つ。化学と生物 Vol 53, No 7, 15 443 る. 食品成分の酸化として一般的な,いわゆる自動酸化と その酸化抑制(抗酸化)のスキームを図1に示した.反 応式1がラジカル開始反応,反応式2から4がラジカル酸・塩基の価数 塩化水素HClや硫酸H 2 SO 4 を水に溶かすと,次のように電離して水素イオンH + を生じます。 HCl → H + + Cl - H 2 SO 4 → 2H + + SO 4 2- このとき,化学反応式と量的関係を考えると,1molの塩化水素HClが電離すると1molの水素イオンH + が生じます。


甲酸 南通嘉睿科技 化工原料



结晶状化合物葡萄糖酸含量50 结晶状化合物葡萄糖酸含量50 价格 结晶状化合物葡萄糖酸含量50 厂家 广州穗欣化工有限公司
ブリタニカ国際大百科事典 小項目事典 オレイン酸の用語解説 二重結合を1個もつ不飽和脂肪酸。化学式 c17h33cooh 。油酸ともいわれ,グリセリドとして多くの動植物油中に含有される。融点 12℃,沸点 360℃の無色無臭の液体。長時間空気にさらすと黄変して異臭を放つ。



酸碱盐化学式图 第1页 一起扣扣网
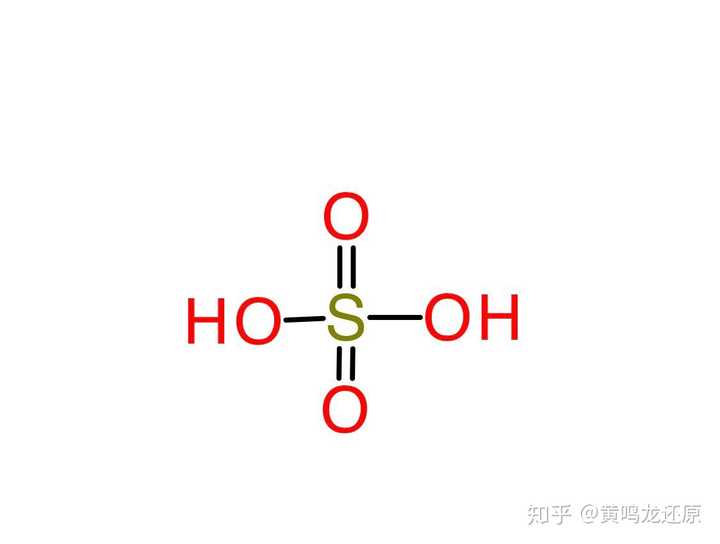


怎么判别化学方程式是否是强酸强碱 知乎


年宁波市中考科学一轮复习专题四酸碱盐 看点快报
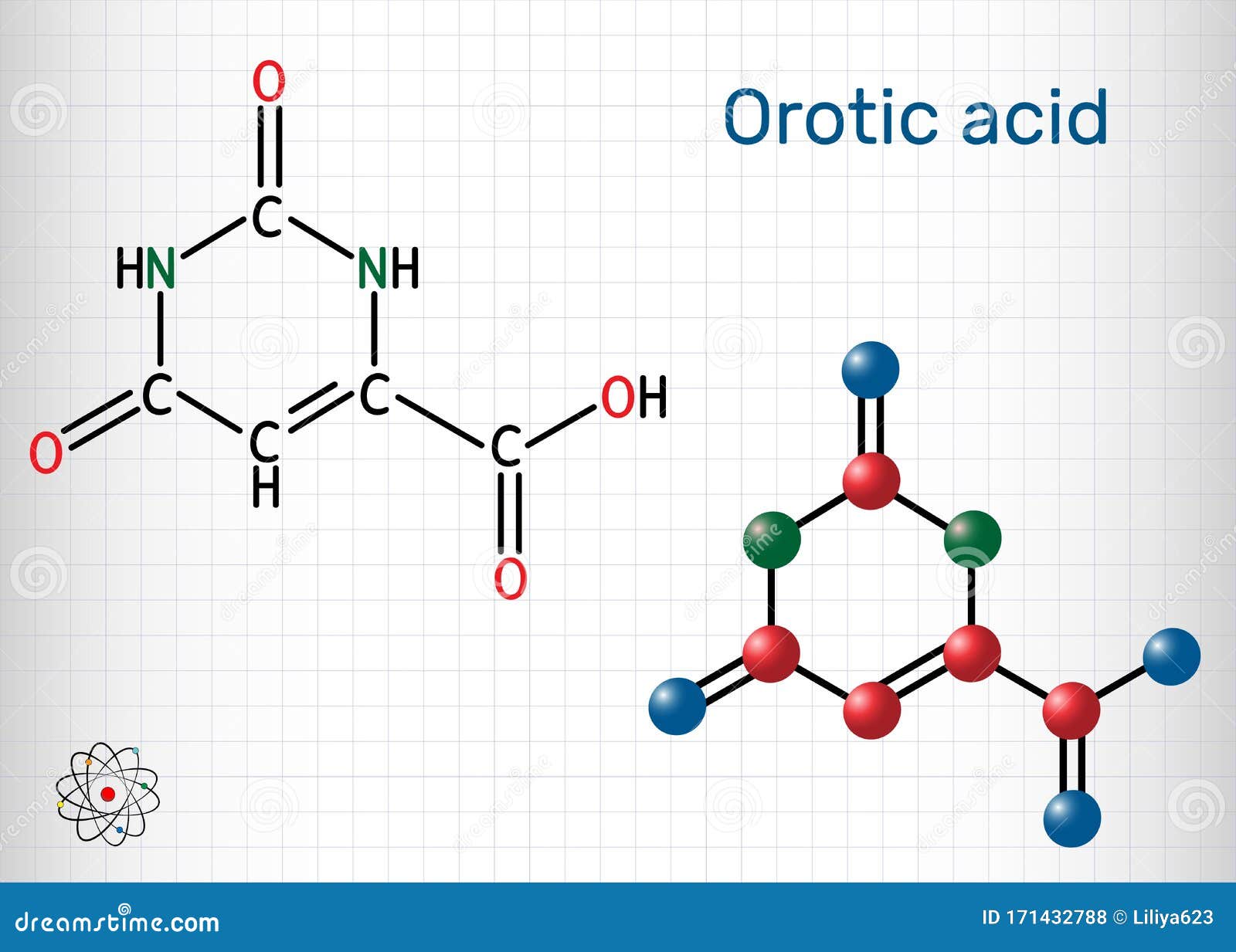


奥氏酸分子它是嘧啶二酮和羧酸结构化学式与分子模型工作表向量例证 插画包括有奥氏酸分子 它是嘧啶二酮和羧酸



高校化学基礎 酸と塩基の性質 練習編 映像授業のtry It トライイット


葡萄糖酸钠 工业葡萄糖酸钠价格 特性 化学式 恒亿化工



人体会产生的消毒液 次氯酸最全科普 简书



葡萄糖酸化学性质 第1页 一起扣扣网
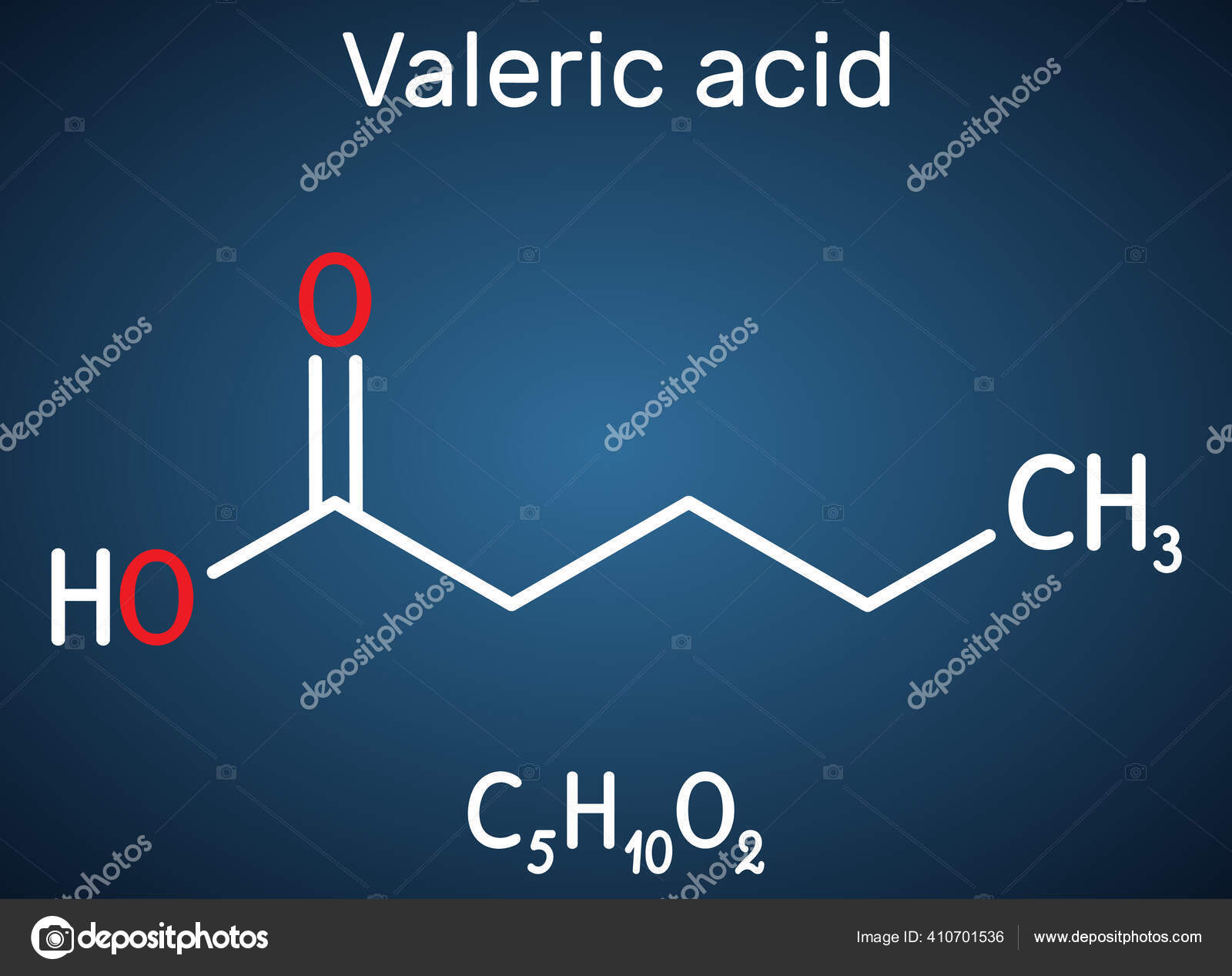


戊酸或戊烷分子深蓝色背景上的结构化学式矢量说明 图库矢量图像 C Avk97 Yandex By


化合价与化学式书写练习 松鼠文库


丙酸 Senking



次氯酸钙化学式ca Clo 2 Buy 次氯酸钙化学式ca Clo 2 次氯酸钙ca Clo 2 次氯酸钙化学配方product On Alibaba Com



九年级化学物质组成的表示方法教案沪教版下载 Word模板 爱问共享资料


硼酸属于几元酸硼酸化学式一级硼酸是几元酸
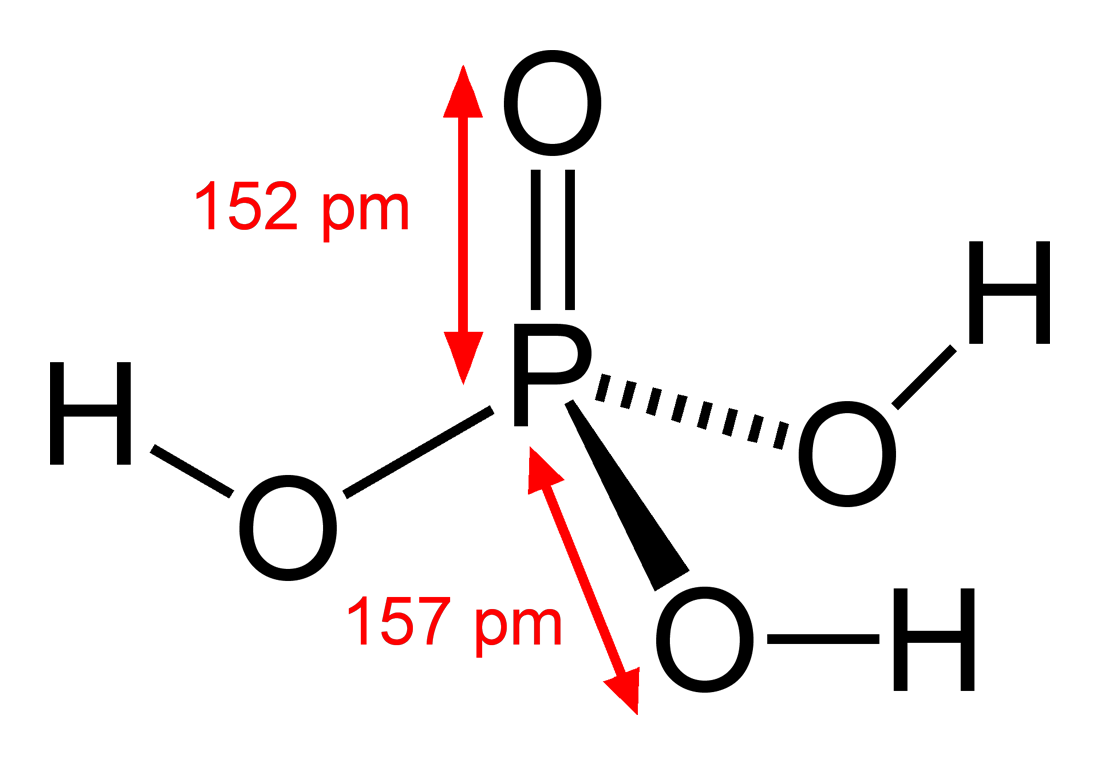


磷酸 维基百科 自由的百科全书


宝石矿物的化学式 有色金属在线


化学常见的酸ppt下载图片预览



水杨酸结构式图片 第1页 一起扣扣网


初三化学化学式与化合价练习题 含答案 及解题方法 Doc 沃文网wodocx Com



森朗 传明酸99 氨甲环酸化学式 C8h15no2中间体 阿里巴巴



初中化学 化学式 化学方程式和反应现象归纳大全 Doc Doc下载


次氯酸的意思次氯酸的解释次氯酸拼音 阶梯文库jieti5 Com


三酸两碱表示化学式 图文 百度文库
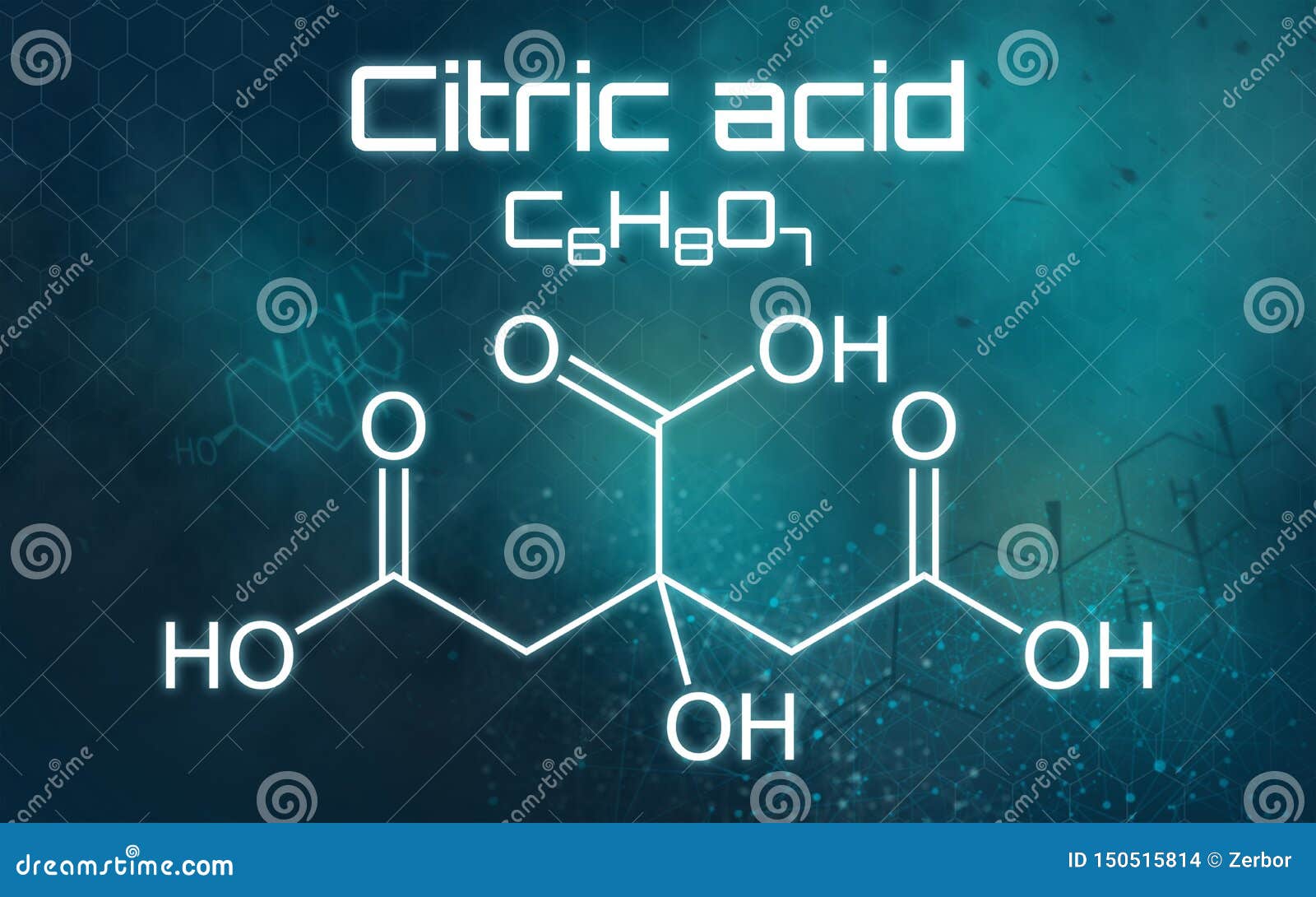


柠檬酸化学式在未来派背景的库存例证 插画包括有柠檬酸化学式在未来派背景的


10 1酸碱盐的概念 图文 百度文库



檸檬酸結構骨架化學式向量圖形及更多分子圖片 Istock


19精选教育专题八化学式与化合价 试题部分 Pptx Ppt 图文 百度文库



Microsoft Word 中考化学酸碱盐推断题强化训练 Pdf 在线文库www Lddoc Cn 在线文库www Lddoc Cn


初三化学化学式 与化合价练习题 含答案 Doc 教育文库 教育资源网www Xsdwk Com 教育文库 教育资源网www Xsdwk Com



乙醯半胱氨酸藥物分子深藍色背景下的結構化學式和分子模型向量圖形及更多健保和醫療圖片 Istock


2


替抗产品系列 酸化剂 戊酸 福州华康牧业有限公司


化学式 离子符号 化学方程式强化练习 文档库
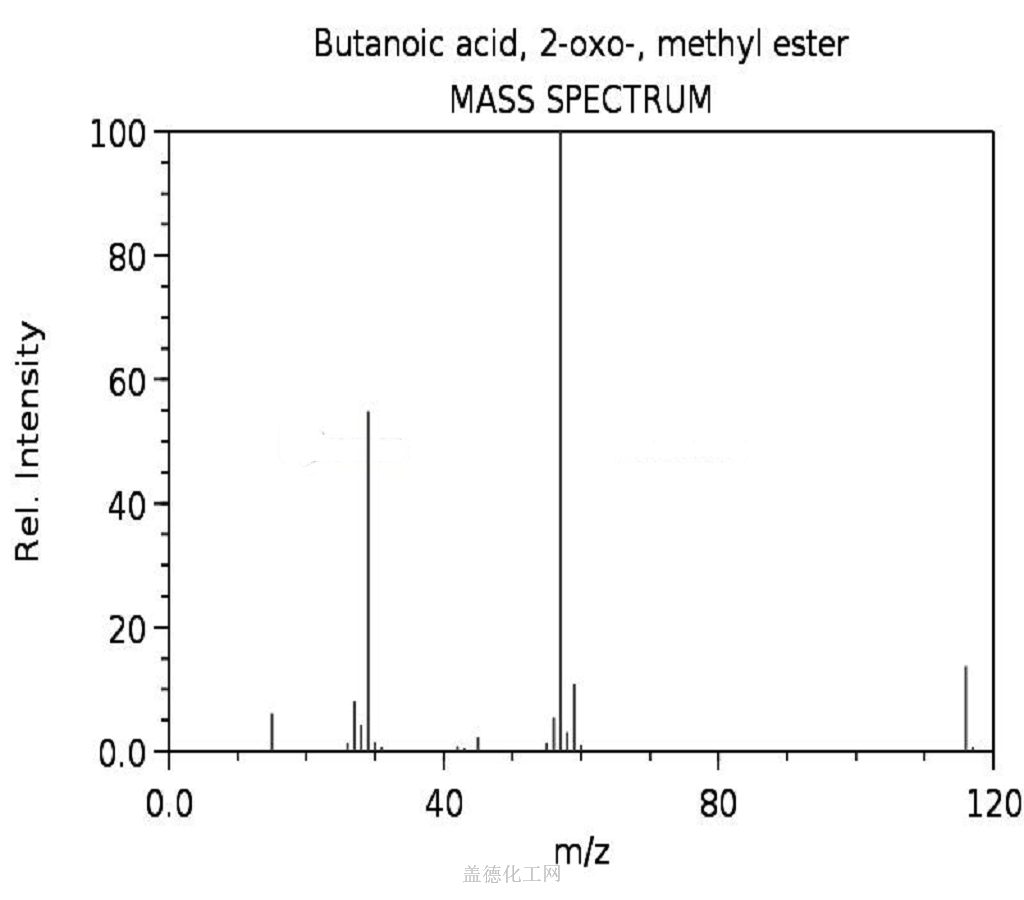


丁酸氯甲酯化学性质香料化学家已经开发出多种酯类人工香料 如丁酸甲酯 化学式为c5h



森朗 传明酸99 氨甲环酸化学式 C8h15no2中间体 阿里巴巴
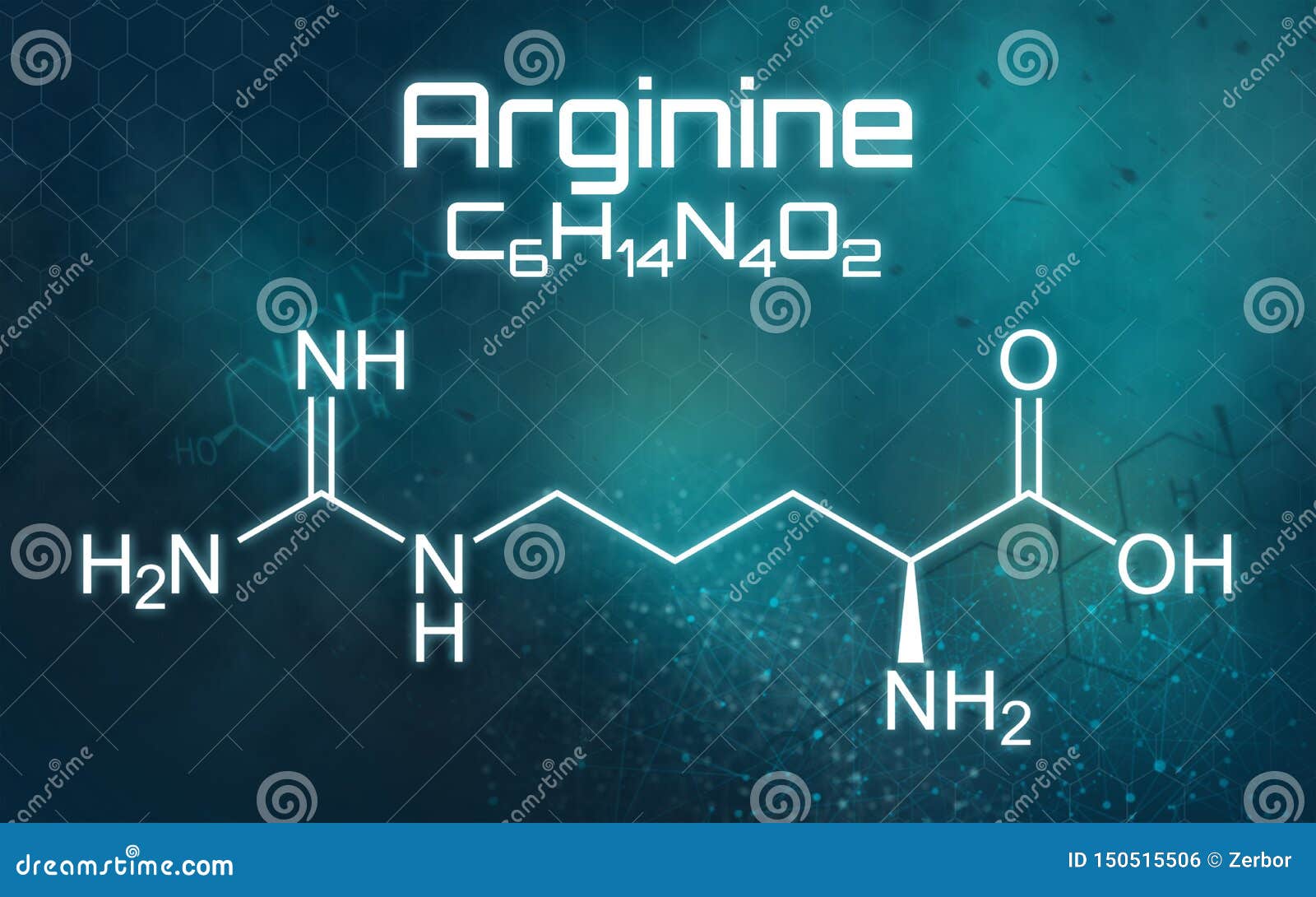


氨基胍基戊酸化学式在未来派背景的库存例证 插画包括有氨基胍基戊酸化学式在未来派背景的



初中化学化学式训练表12下载 Word模板 爱问共享资料



有人問的次氯酸鈉水溶液跟業者賣的次氯酸水溶液 其差異為何 Im5481



盐酸和盐酸之间的区别 21 新闻



富马酸亚铁化学式 第1页 一起扣扣网


化学酸碱盐必备知识点一化合价 1 哔哩哔哩 つロ干杯 Bilibili



酸碱中和滴定考题含答案 Doc 牛牛文库niuwk Com


酸碱中和反应化学式 第1页 要无忧健康图库


次氯酸化学式 Hcl是什么化学名称 次氯酸高氯酸 次氯酸电子式



硫氰酸胍生产厂家价格180元 千克厂家 广州宏程生物科技有限公司
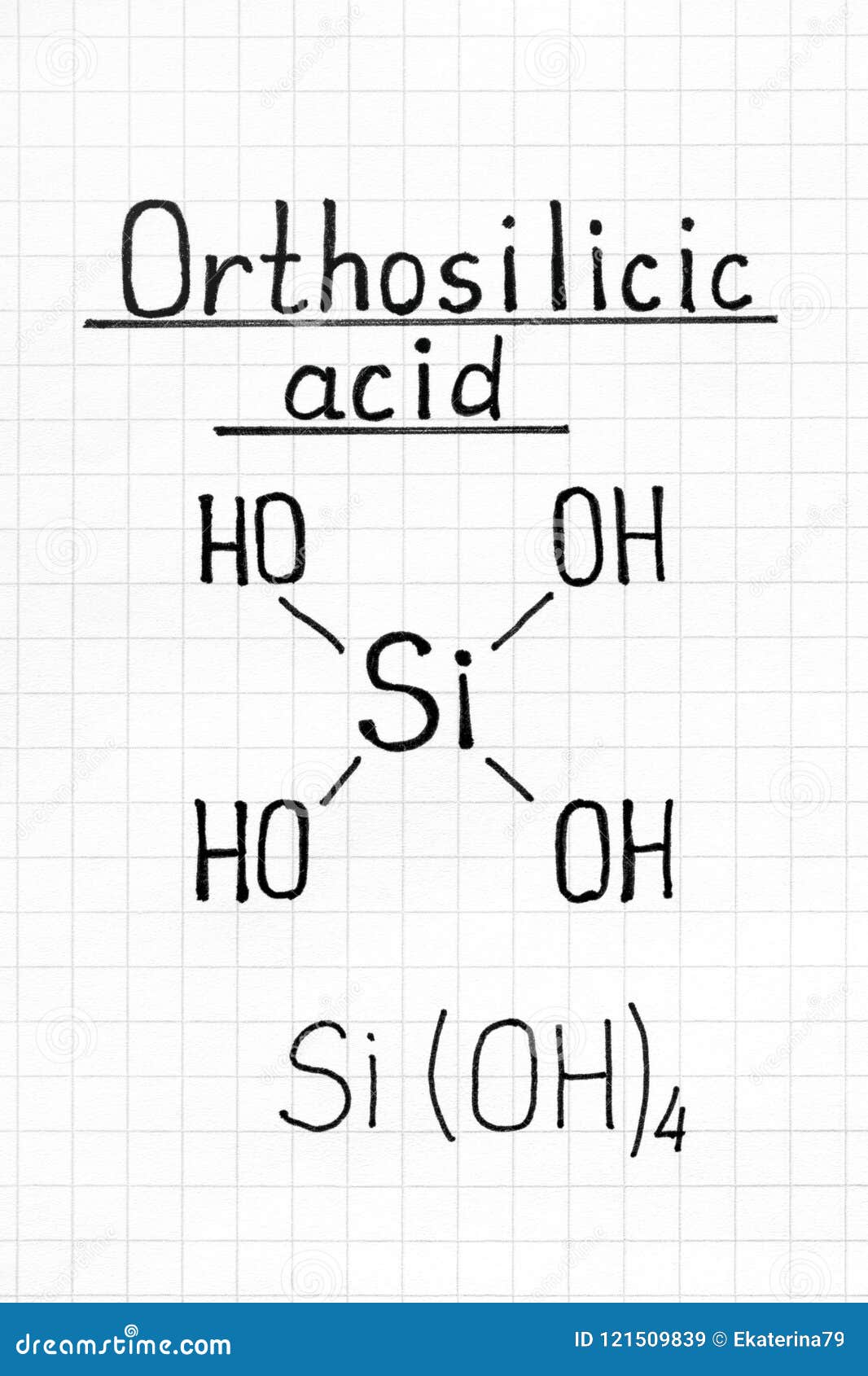


Orthosilicic酸化学式库存例证 插画包括有orthosilicic酸化学式



化学式小测验安卓下载 安卓版apk 免费下载



中学化学化学式 化学方程式汇总microsoftword文档 2 金锄头文库
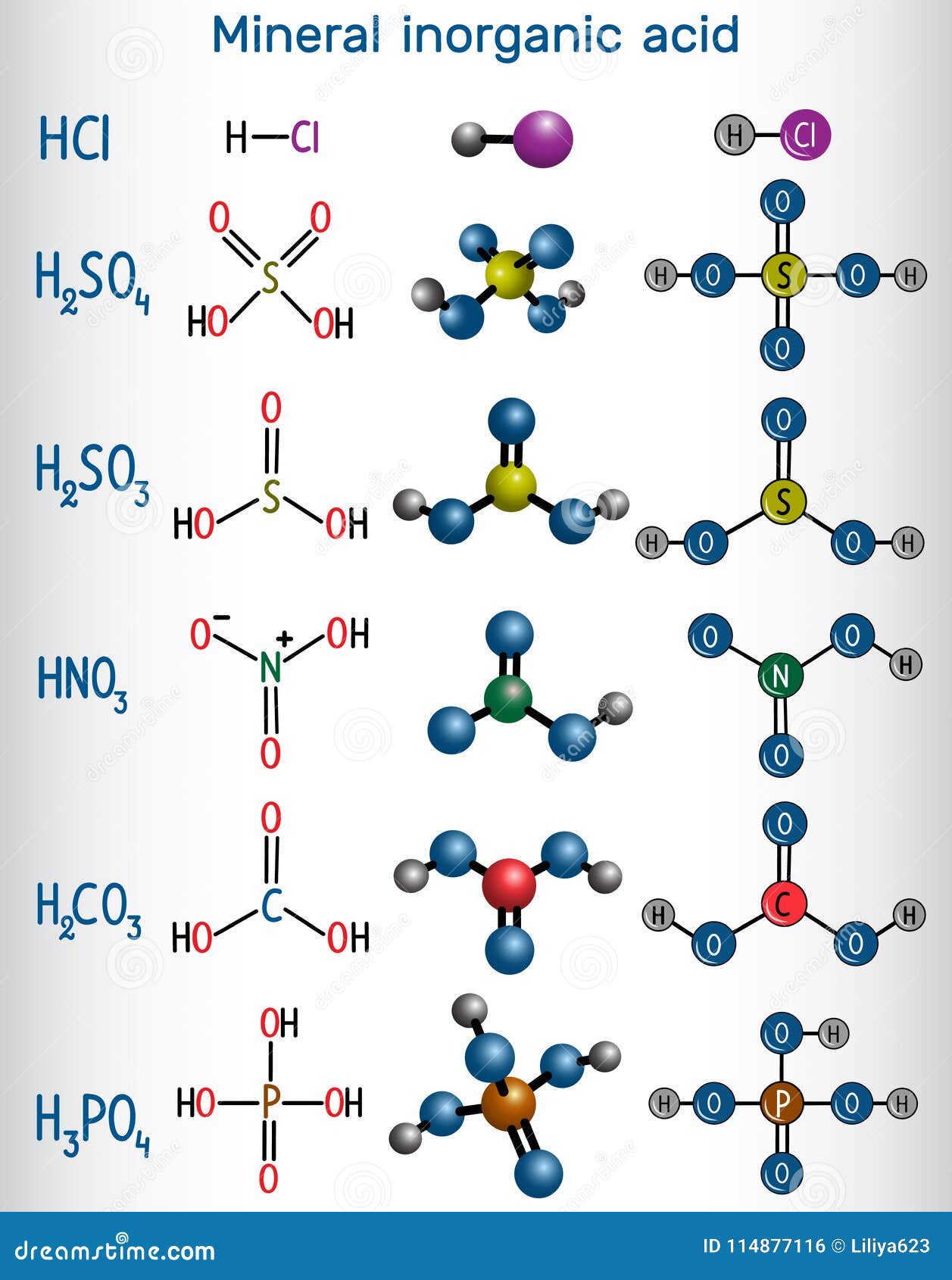


化学式和分子式样矿物无机酸水力向量例证 插画包括有水力 化学式和分子式样矿物无机酸


初中常见化学式与化学方程式大全 Doc22 Doc 沃文网wodocx Com


化学分子式及性质 Doc 十八文库


人教版九年级化学第四单元课题4 化学式与化合价 Czhx0013 初中化学 学习资料大全 免费学习资源下载


知识汇总 中考化学 出勤率最高的酸 碱 盐知识 冲刺高分不在话下 思维
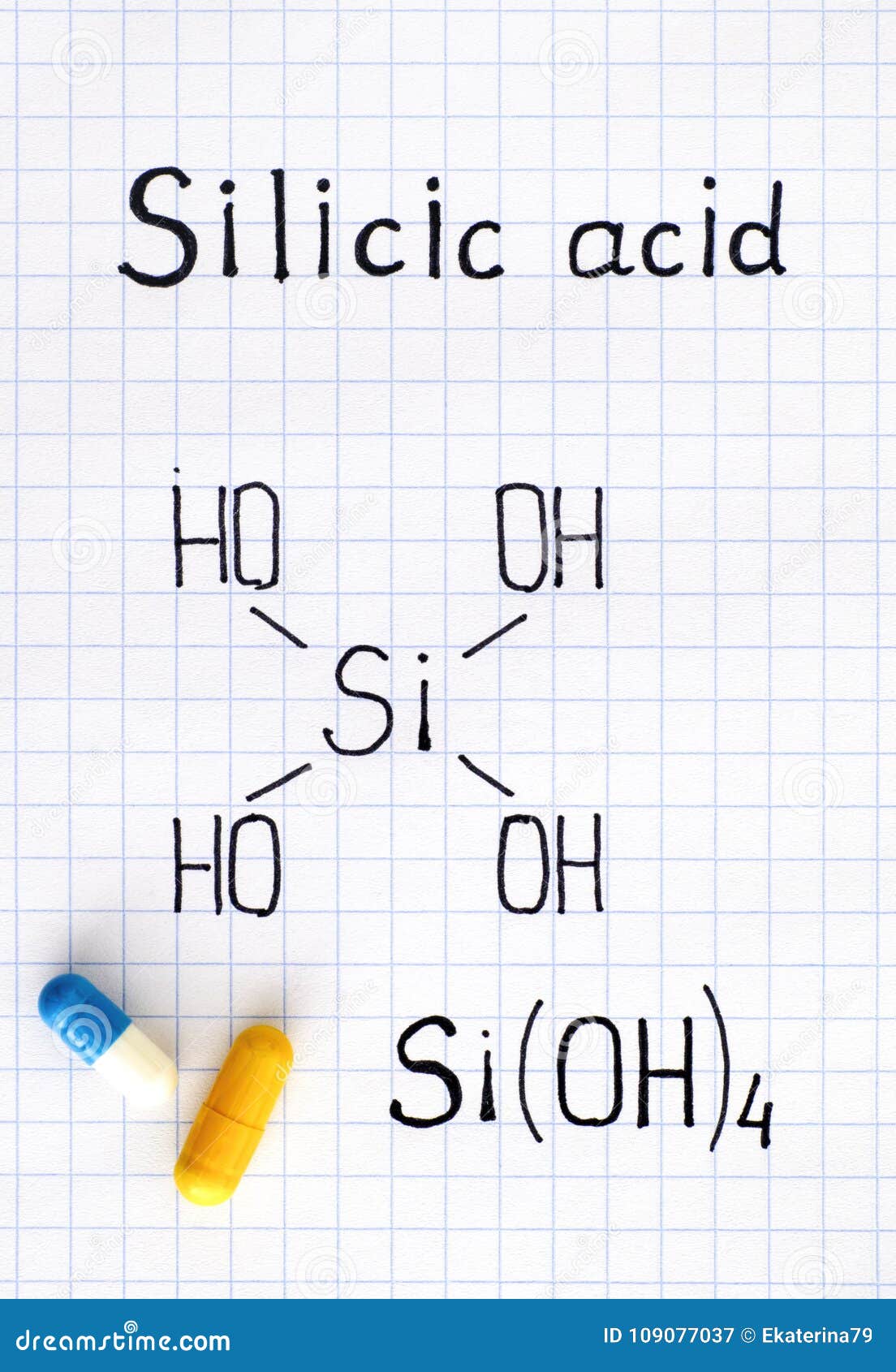


硅酸化学式与两个药片的库存图片 图片包括有硅酸化学式与两个药片的



6 1 酸と塩基 おのれー Note



Cna 1 萘胺8 磺酸的制备方法 Google Patents



次氯酸 维基百科 自由的百科全书


硫氰酸铵 硫氰酸铵化学式 硫氰酸铵的用途 硫氰酸铵价格



玻尿酸 维基百科 自由的百科全书


初中常见化合物化学式 松鼠文库


九年级上册化学必须记住的化学式和化学方程式 教习网 课件下载
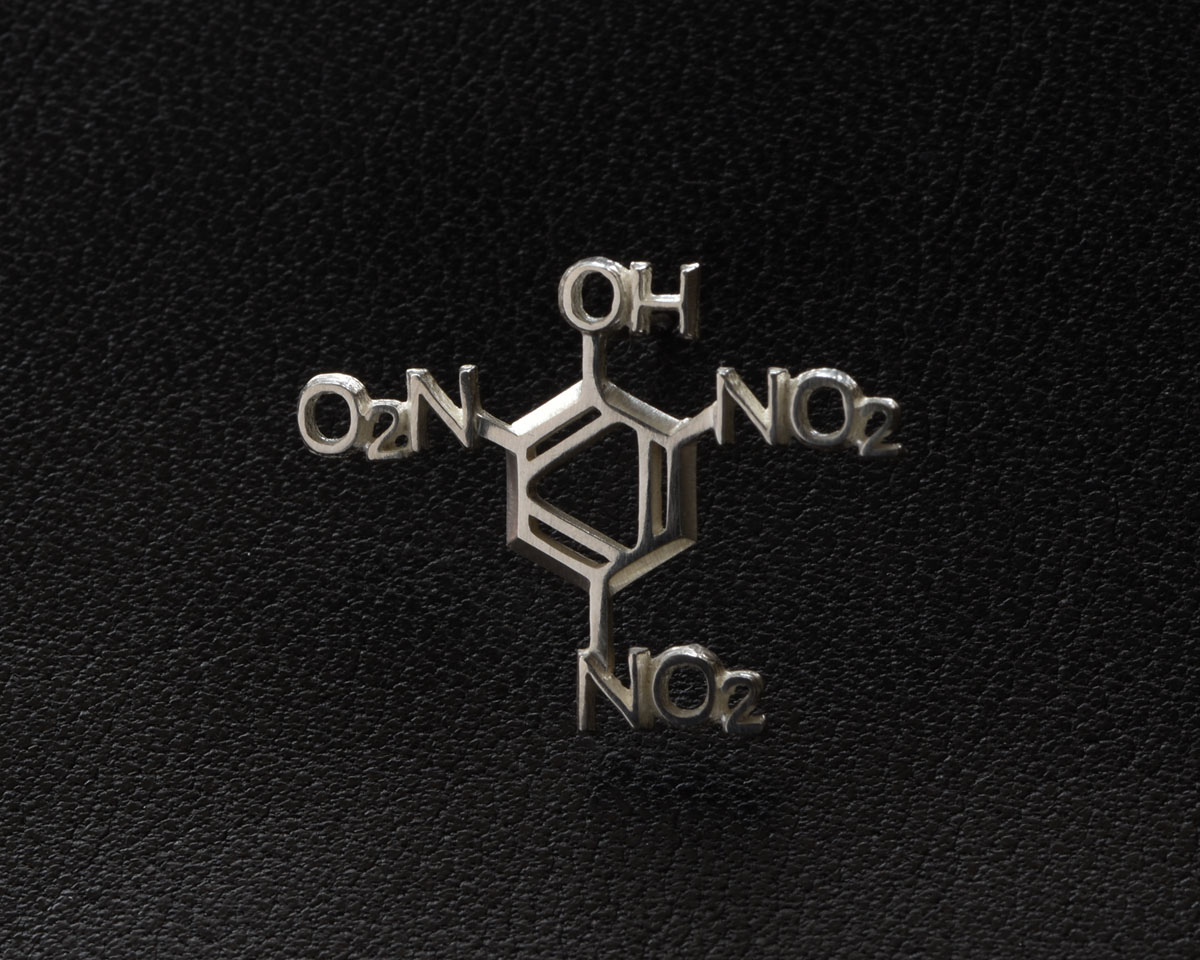


ピクリン酸 化学式ピアス 片耳 Iichi ハンドメイド クラフト作品 手仕事品の通販



丙酸 维基百科 自由的百科全书



Ppt 第五章酸碱平衡powerpoint Presentation Free Download Id



碳酸盐生成化学式 第1页 图说健康



Cna 喷墨打印用水溶性和耐水性染料 Google Patents


2



初中常见化学式及化学方程式大全 七七文库www 77wenku Com



人教版初中化学九年级上册ppt课件 课题4 化学式与化合价下载 Ppt模板 爱问共享资料



高中化学常见酸碱盐2 金锄头文库


锌离子化学式 氧化锌化学式 碳酸锌化学式 葡萄糖酸锌化学式



ヒアルロン酸の化学式 分子構造のイラスト素材 ベクタ Image


Jeff 哪一种肌酸才是最好的 不是一水肌酸 兔子的健身杂谈 微信公众号文章阅读 Wemp


碳酸二氧化碳路易斯结构碳酸氢盐 化学式png剪贴画球体 化学 酸 免抠素材下载 图片id 其它元素 Png素材 素材宝scbao Com



头条文章



硅单质和硅酸盐 高中化学必修一ppt课件 第4 1 2课时 Mac下载



最良かつ最も包括的な酸化学式



详细说明氯酸钠化学式为naclo3 相对分子质量106 44 通常为白色或微黄色等轴晶体 地一眼
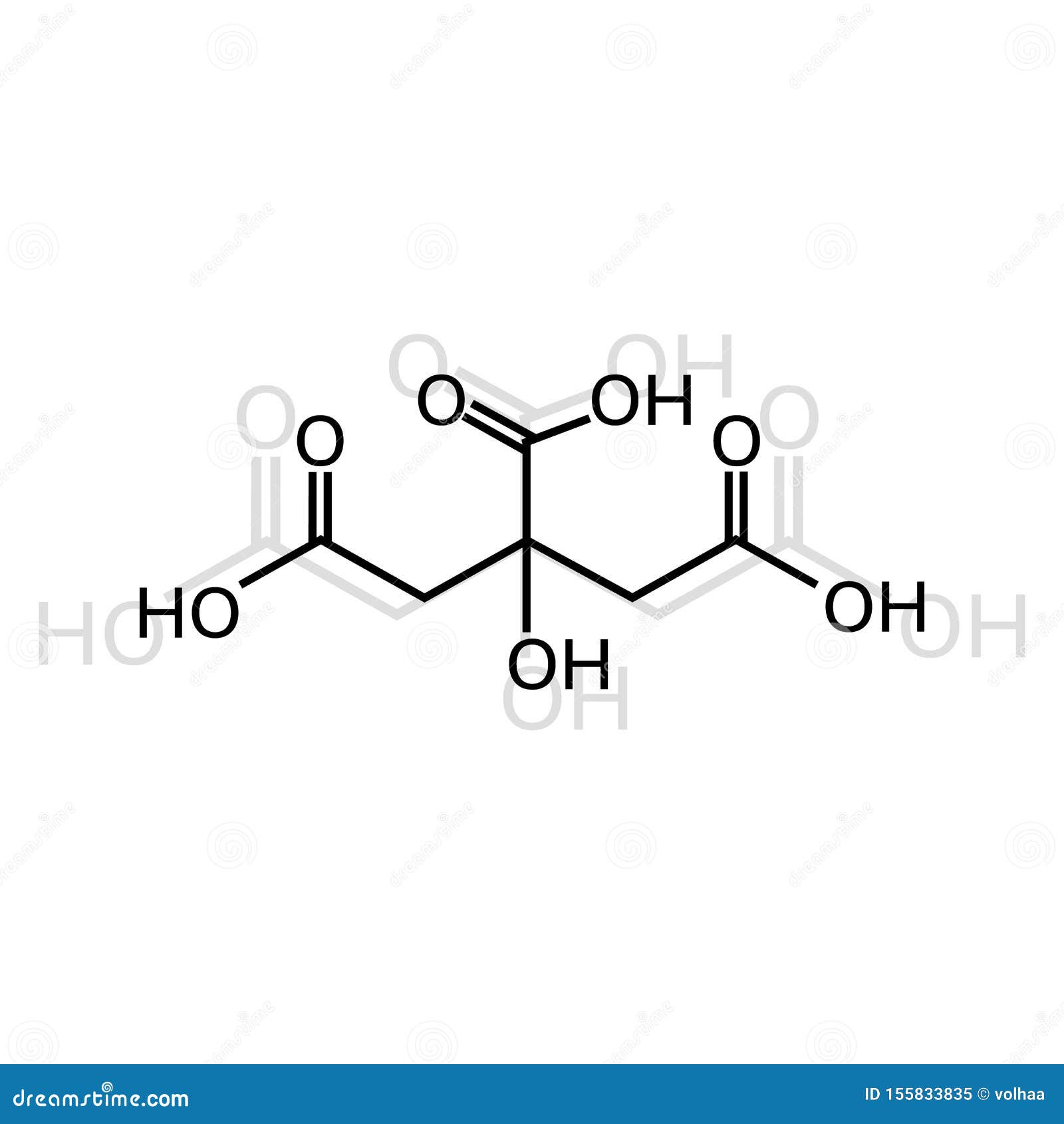


柠檬酸化学式向量例证 插画包括有柠檬酸化学式


课化入微 初中化学第二单元第三节 高锰酸钾铺垫 哔哩哔哩 つロ干杯 Bilibili



周知 高壓蒸煮不能破壞米酵菌酸毒性 警惕有毒食物 熱備資訊



初三化学化学式计算题练习题 人人文库网



鸡用微量元素添加剂 三人行教育网 Www 3rxing Org


氢碘酸 氢碘酸直销 氢碘酸供货商 第2页 风信微商圈


Ppt 物质的分类powerpoint Presentation Free Download Id



课题4 化学式与化合价开始学习 Ppt Download



0 件のコメント:
コメントを投稿